А.Ю. Сеидова, к.м.н., врач-кардиолог1
А.Е. Коровин, д.м.н., доцент, профессор кафедры патологии2
А.В. Барсуков, д.м.н., профессор, заместитель начальника кафедры госпитальной терапии3
1ФКУЗ «Медико-санитарная часть Министерства внутренних дел Российской Федерации по г. Санкт-Петербургу и Ленинградской области», г. Санкт-Петербург, Россия
2ФГБОУ ВО «Санкт-Петербургский государственный университет» Правительства Российской Федерации, Санкт-Петербург, Россия
3ФГБВОУ ВО «Военно-медицинская академия имени С. М. Кирова» МО РФ, г. Санкт-Петербург, Россия
Phosphodiesterase inhibitors: could they be beneficial for the treatment of SARS-CoV2 infection?
A.Yu. Seidova1, A.E. Korovin2, A.V. Barsukov3
Health Unit of Internal Ministry of the Russian Federation in St Petersburg and
Leningrad region, Saint Petersburg, Russia;
Saint-Petersburg State University, Saint Petersburg, Russia
Military Medical Academy named after S. M. Kirov, Saint Petersburg, Russia
Резюме
В условиях пандемии новой коронавирусной инфекции (SARS-CoV-2, COVID-19) активно изучаются потенциально полезные основные и дополнительные эффекты ряда классических и современных лекарственных средств. В статье приведены научно-обоснованные положения, позволяющие рассматривать ингибиторы фосфодиэстеразы-5 (ФДЭ-5) качестве средств, патогенетически оправданных в ходе терапии SARS-CoV-2 инфекции и её осложнений. Описаны механизмы влияния данного класса препаратов на компоненты ренин-ангиотензин-альдостероновой системы, регуляция функций которых может быть актуальной не только для ограничения пульмональной вазоконстрикции, но и замедления инвазии коронавируса в клетку хозяина. Отражена важная для лечения пациентов с COVID-19 способность ингибиторов ФДЭ-5 к улучшению внутрилёгочной гемодинамики и эндотелиальной функции, подавлению интенсивности воспалительного процесса, оксидативного стресса, апоптоза, локального тромбообразования, развития фиброза и сосудистого ремоделирования в лёгочной ткани.
Ключевые слова: новая коронавирусная инфекция, ингибитор фосфодиэстеразы-5, ангиотензин-II, воспаление, внутрилёгочная гемодинамика, клеточные и сосудистые эффекты.
Summary
In the context of a pandemic of a new coronavirus infection (SARS-CoV-2, COVID-19), potentially useful main and additional effects of a number of classic and modern medicines are being actively studied. The article presents scientifically grounded provisions that allow considering phosphodiesterase-5 (PDE-5) inhibitors as agents pathogenetically justified during the therapy of SARS-CoV-2 infection and its complications. There described the mechanisms of this class of drugs effect on the renin-angiotensin-aldosterone system (RAAS) components. The regulation of RAAS functions may be relevant not only to limit pulmonary vasoconstriction, but also to slow down the invasion of the coronavirus into the host cell. There reflected the ability of PDE-5 inhibitors to improve intrapulmonary hemodynamics and endothelial function, suppress the intensity of the inflammatory process, oxidative stress, apoptosis, local thrombus formation, the development of fibrosis and vascular remodeling in the lung tissue, which is important for the treatment of patients with COVID-19.
Key words: novel coronavirus infection, phosphodiesterase-5 inhibitor, angiotensin-II, inflammation, intrapulmonary hemodynamics, cellular and vascular effects.
Введение
На протяжении последних нескольких лет человечество столкнулось с серьёзными инфекционными угрозами, обусловленными вирусами Ebola [1], Zika [2] и SARS-CoV-2 (заболевание, вызванное новым коронавирусом (COVID-19)). В марте 2020 г. Всемирная организация здравоохранения заявила о том, что тяжёлый острый респираторный синдром, обусловленный новым коронавирусом, приобрёл масштабы пандемии [3]. Несмотря на значительный рост знаний о патогенезе и клинических проявлениях SARS-CoV2-инфекции, оптимальной схемы лечения и профилактики её осложнений, удовлетворяющей критериям современной доказательной медицины, до сих пор не разработано.
В этом контексте фосфодиэстеразы (ФДЭ), эволюционно сформированные ферменты, подвергающие гидролизу циклические нуклеотиды (циклические аденозин и гуанезин монофосфаты (цАМФ и цГМФ)), могут стать новыми потенциальными мишенями в лечении и профилактике проявлений и осложнений SARS-CoV-2-инфекции. Учитывая вариабельно широкое распространение и модулирующую роль этих ферментных систем практически во всех органах и тканях, к настоящему времени разработано большое количество препаратов для контроля конкретных функций каждого семейства ФДЭ. В мировой практике накоплен определённый опыт применения неселективных и новых высоко селективных ингибиторов ФДЭ при лечении заболеваний, протекающих с клинико-патофизиологическими признаками и процессами, полностью или частично совпадающими с таковыми при COVID-19 (например, тромбоз, воспаление, фиброз, бронхоспазм) [4].
К настоящему времени васкулярные эффекты ингибиторов ФДЭ-5 изучены наиболее тщательно и определяют известные современные клинические показания (эректильная дисфункция и лёгочная артериальная гипертензия) к применению данного класса препаратов (силденафил, тадалафил, варденафил). Сосудистый тонус во многом детерминирован доступностью эндотелиального оксида азота (NO), который диффузно распространяется на прилегающие гладкомышечные клетки и стимулирует продукцию цГМФ, приводя к релаксации сосудистой стенки и вазодилатации. Ингибиторы ФДЭ-5 повышают уровень цГМФ, потенцируя вазодилатацию. Фосфодиэстераза-5 особенно интенсивно экспрессирована в сосудистом русле полового члена, а также в системе лёгочной артерии [5]. В практике экспериментальных и клинических исследований ингибиторы ФДЭ-5 ранее продемонстрировали благоприятное влияние на многочисленные патологические процессы, что позволяет предположить их потенциальную пользу при SARS-CoV-2-инфекции. На рисунке 1 отражены патологические процессы, актуальные при SARS-CoV-2 инфекции и представляющие мишень для ингибиторов ФДЭ-5.
Ниже приведены научно-обоснованные положения, позволяющие рассматривать ингибиторы ФДЭ-5 и, в частности, силденафил-кардио, в качестве средств для лечения больных новой коронавирусной инфекцией.
А. Противодействие ангиотензин-II опосредованному снижению регуляторной активности АТ1-рецепторов
Установлено, что сигнальные пути ангиотензина-II и оксида азота тесно взаимосвязаны. Как известно, ангиотензин II участвует в регуляции экспрессии синтазы оксида азота (NO-синтазы) и продукции NO, который подавляет активность рецептора 1 типа ангиотензина-II (АТ1-рецептор). Кроме того, находящиеся в нижней иерархии относительно ангиотензина-II и NO эффекторные субстанции также взаимодействуют друг с другом по механизму отрицательной обратной связи [6]. Предполагается, что ингибиторы ФДЭ-5, ограничивают пульмональную вазоконстрикцию, вызванную усилением активности АТ1-рецепторов вследствие связывания коронавируса с рецептором ангиотензин-превращающего фермента 2 типа (АПФ2-рецептором) в альвеолярных клетках, бронхиальном эпителии, сосудистом эндотелии через сигнальный путь оксид азота / растворимая гуанилат-циклаза / циклический гуанезин-монофосфат (NO/рГЦ/цГМФ) [7, 8].
Существует гипотеза о том, что эндогенный ангиотензин II противодействует вирусу SARS-CoV-2 посредством нескольких механизмов. Во-первых, ангиотензин-II, конкурируя с коронавирусом за АПФ2-рецептор, в процессе естественной деградации и гидролиза до ангиотензина–(1-7) связывается с АПФ2. Во-вторых, воздействие ангиотензина-II на АТ1-рецептор способствует интернализации и ослаблению активности АПФ2 через сигнальный путь внеклеточной регулируемой киназы 1/2 (ERK1/2) и митоген-активированной киназы (MAP) [9, 10]. В-третьих, ангиотензин-II участвует в АТ1-рецептор-зависимой деструкции АПФ2 через убиквитинирование и лизосомальный транспорт. Таким образом, конкурентное ингибирование, ослабление регуляторной активности, интернализация и последующее разрушение АПФ2 снижают интенсивность проникновения вирусной инфекции в клетки хозяина [11].
С учётом современных представлений об особенностях клеточной инвазии новых коронавирусов с вовлечением АПФ2-рецепторов, появились сообщения [12] о потенциальной возможности применения ряда препаратов в лечении COVID-19 в связи с наличием у них ингибирующих свойств в отношении 3CL-протеазы спайк-белка вируса SARS-CoV-2. Авторы установили, что подобными свойствами обладают саквинавир, силденафил, тадалафил, ривароксабан, дазатиниб, варденафил, монтелукаст.
Б. Вмешательство в патологический процесс на уровне лёгочной ткани
Ингибиторы ФДЭ-5 уместны для лечения заболеваний легких, поскольку именно здесь наблюдается высокая экспрессия одноимённого фермента, обладающего значимой специфичностью для гидролиза цГМФ [13]. Существенно, что силденафил, а также тадалафил в 2005 и 2009 г.г. соответственно были одобрены к применению Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (US FDA) и Европейским агентством лекарственных средств (ЕМА) в интересах лечения лёгочной артериальной гипертензии у взрослых и детей [14]. Эксперты Европейского общества кардиологии / Европейского респираторного общества (ESC/ERS, 2015) рекомендовали для терапии лёгочной артериальной гипертензии силденафил, тадалафил, а также допустили применение тадалафила [15].
Улучшение функции эндотелия и предупреждение нарушений артериальной релаксации считаются основными механизмами благотворного влияния ингибиторов ФДЭ-5 у таких пациентов [16, 17]. В определённой мере протективные свойства силденафила при лёгочной артериальной гипертензии обусловлены его способностью к супрессии множества цитокинов (цитокин-индуцированный нейтрофильный хемоаттрактант 1 и 2α/β, тканевой ингибитор металлопротеиназы 1, интерлейкин 1α, липополисахарид-индуцированный хемокин α, монокин-индуцированный γ-интерферон, макрофагальный воспалительный протеин 1α и 3α), участвующих в привлечении в данную область нейтрофилов и мононуклеартных клеток. Кроме того, силденафил продемонстрировал свойство подавлять внеклеточную сигнал-регулируемую киназу 1/2 и митоген-активируемую протеинкиназу и усиливать цитопротекторный сигнальный путь протеинкиназы В [18, 19].
В случаях острого повреждения легочной ткани, позитивные свойства силденафила заключаются в подавлении пролиферации регуляторных Т-клеток и продукции провоспалительных цитокинов, аутоантител, а также в модуляции активации тромбоцитов, ангиогенеза и пульмональной вазореактивности [20]. Доказана способность силденафила ограничивать миграцию нейтрофилов в ткань лёгких, уменьшать высвобождение провоспалительных медиаторов (фактор некроза опухоли альфа (ФНО-α), интерлейкин 8, интерлейкин 6), соотношение нитрит/нитрат, уровень маркёров оксидативного стресса (3-нитротирозин и малоновый диальдегид), сокращать отёчность легочной паренхимы, содержание белка в бронхоальвеолярном лаваже, апоптоз эпителиальных клеток с улучшением функциональных респираторных параметров [21].
Установлено, что назначение силденафила при тяжёлой форме хронической обструктивной болезни лёгких улучшает лёгочную гемодинамику за счёт подавления вызванной гипоксией вазоконстрикции, а также облегчает отлучение этих пациентов от аппаратов вспомогательной вентиляции и улучшает показатели функции внешнего дыхания и газообмена [22]. Показано, что при гипоксических состояниях применение силденафила ассоциируется с увеличением толерантности к физической нагрузке в условиях нормобарической гипоксии вследствие улучшения артериальной оксигенации [23]. J.S. Gibbs et al. (2007) [24] связали пользу от применения силденафила с уменьшением гипоксической пульмональной вазоконстрикции, увеличением ударного объёма сердца. N. Watanabe et al. (2011) [25] отметили способность силденафила приводить к снижению пульмонального сосудистого сопротивления, уменьшению одышки у больных интерстициальной пневмонией. В работе E. Gammella et al. (2013) [26] было обнаружено, что терапия силденафилом в сочетании с эритропоэтином защищает клетки эндотелия при различных гипоксических состояниях. D. Czövek et al. (2014) [27] сообщили о редукции гиперреактивности бронхиального дерева, обусловленной гипоксией, за счёт поддержания нормального дыхательного объёма в конце выдоха и подавления воспаления в воздухоносных путях.
Продемонстрировано свойство силденафила усиливать внутриклеточный синтез сероводорода, который считается одним из эндогенных ингибиторов фосфодиэстеразной активности и, следовательно, регуляторов пролиферации гладкомышечных клеток лёгочной артерии, активности воспалительного процесса и оксидативного стресса [28, 29]. Этот факт, по-видимому, важен в аспекте предупреждения ремоделирования стенки лёгочной артерии и повышения в ней артериального давления в процессе и после перенесённой SARS-CoV-2-ассоциированной пневмонии. Установлено, что назначение силденафила в профилактических целях (перед гипероксическим повреждением лёгких) сопровождалось значительным увеличением в легочной ткани уровня цГМФ (а также замедлением его деградации), сокращением депозиции фибрина, уменьшением содержания общего белка в бронхоальвеолярном лаваже и степени активности воспаления [30].
Важным в аспекте профилактики COVID-ассоциированных осложнений следует считать доказанную способность силденафила и тадалафила подавлять миграцию клеток эндотелия и гладко-мышечных клеток в мезенхиму лёгочных артерий, что препятствует тромбообразованию in situ [8]. Актуальность применения ингибиторов ФДЭ-5 не только в фазе активного поражения лёгочной паренхимы, но и после её завершения также представляется очевидной, поскольку экспериментально и отчасти клинически установлено вмешательство этих средств в такие патологические процессы как воспаление, фиброз, тромбоз [31].
С. Антивоспалительная эффективность и влияние на другие клеточные процессы
Ингибиторы ФДЭ-5 воздействуют на одноимённый энзим, ответственный за селективную деградацию цГМФ, приводя к увеличению его накопления внутри клеток. Циклический ГМФ обладает антивоспалительными свойствами за счёт понижения экспрессии ряда провоспалительных цитокинов – интерлейкина 1β и фактора некроза опухоли альфа (ФНО-α), а также увеличения экспрессии антивоспалительного цитокина интерлейкина 10 [32]. В этом контексте М. Dalamaga et al. (2020) [33] акцентировали внимание на значимости подавления ФДЭ-4 и цАМФ в интересах ослабления цитокинового шторма при COVID-19 за счёт поддержания баланса провоспалительных и антивоспалительных факторов. Авторы полагают, что селективные ингибиторы ФДЭ-4 могли бы оказаться актуальными средствами лечения ранней фазы поражения лёгких при SARS-CoV-2 инфекции, когда ещё не развился цитокиновый шторм и не возникла тяжёлая полиорганная дисфункция. Имеется немало фактов, подтвердивших при COVID-19 клиническую пользу деривата метил-ксантина – пентоксифиллина, который через подавление активности ФДЭ-4, проявлял необходимые противовирусные, антивоспалительные, иммуномодуляторные, антитромботические, протективные респираторные свойства [34].
В экспериментальной модели ингибиция ФДЭ-5 оказалась весьма полезной в аспекте профилактики септического поражения лёгких и почек за счёт улучшения антиоксидантного потенциала и снижения содержания в крови ФНО-α [35]. Отмечено, что увеличение биодоступности цГМФ является патогенетически значимым для ослабления воспаления, ассоциированного с сепсисом [36]. Показано, что терапия силденафилом сопровождается устойчивым снижением сывороточного уровня фибриногена, высокочувствительного С-реактивного белка, интерлейкина 6, ФНО-α независимо от их исходных значений [37].
Сообщается об участии цГМФ-зависимой протеин-киназы в комплексе клеточных сигнальных реакций, оказывающих влияние на жизнеспособность клеток и апоптоз [38]. Так, D. Choi et al. (2009) [39] установили, что силденафил замедляет апоптоз посредством увеличения активности индуцируемой (iNOS) и эндотелиальной (eNOS) синтаз оксида азота, уровня внутриклеточного белкового фактора Bcl-2. D. Puzzo et al. (2014) [40] показали, что силденафил подавляет экспрессию молекул апоптоза, таких как каспаза-3, Bax, р38-митоген-активированные протеинкиназы. E. Duarte-Silva и C. Peixoto (2018) [41] обнаружили, что силденафил замедляет апоптоз с участием двух взаимосвязанных механизмов: прямого за счёт модуляции экспрессии каспазы и непрямого за счёт модуляции экспрессии молекул, регулирующих процессы клеточной гибели и/или клеточного выживания. Силденафил также оказывает супрессивное влияние на интенсивность процессов в эндоплазматическом ретикулуме (ER) и обусловленный ими апоптоз за счёт снижения экспрессии X-Box-связывающего протеина-1, фосфопротеин-киназоподобной ER-киназы [42].
Ингибиторы ФДЭ-5 индуцируют экспрессию фермента гемоксигеназы-1 через путь: растворимая гуанилат-циклаза (рГЦ) – цГМФ [43]. Гемоксигеназа-1 катализирует оксидативную деградацию гема в биливердин и монооксид углерода, который имеет много общих свойств с оксидом азота, включая активацию опосредованной растворимой гуанилат-циклазой передачи сигнала и регуляции генов [44]. Гемоксигеназа-1 и продукты её реакции, такие как монооксид углерода, являются эффективными индуцибельными антиоксидантами и анти-апоптическими молекулами, которые препятствуют процессам воспаления, расщепления адгезивных белков, апоптоза путем ограничения активности белковых факторов p53 и Bcl2 [45]. Кроме того, отмечено, что гемоксигеназа 1 обладает противовирусной активностью за счет ингибирования роста вирусов [46].
Ингибиторы ФДЭ-5, включая силденафил, действуют как антиоксиданты, подавляя образование свободных радикалов, поддерживая антиоксидантные окислительно-восстановительные системы [47]. Так, было продемонстрировано, что защитное действие силденафила на эпителиальные клетки является следствием ингибирования ксантиноксидазы с уменьшением образования свободных радикалов кислорода [48]. Как известно, оксид азота подавляет агрегацию тромбоцитов преимущественно через цГМФ-зависимые процессы [49]. I. Gudmundsdóttir et al. (2005) [50] подтвердили наличие антитромбоцитарных свойств у ингибиторов ФДЭ-5, установив, что силденафил потенцирует NO-ассоциированное ослабление агрегации тромбоцитов через блокаду метаболизма цГМФ. Клинико-патогенетическая значимость ингибиции ФДЭ-5 в кардиоваскулярной медицине ранее была обзорно отражена нами в доступной печати [51].
Заключение
Пандемические масштабы распространённости COVID-19 поспособствовали беспрецендентным усилиям мирового медицинского научного сообщества в отношении поиска лекарственных средств для контроля инфекции и спасения жизней больных. В этих ургентных обстоятельствах изучение дополнительных (считающихся off-label), но в данном контексте полезных эффектов фармакотерапии, может иметь важное лечебное и прогностическое значение.
Применение инновационных препаратов, а также тех, которые тщательно изучались на протяжении многих лет, позволило расширить возможности эффективной противовирусной и иммуно-корригирующей терапии. Так, в арсенале врача для борьбы с SARS-CoV-2 инфекцией появились многие средства (в т.ч. ранее применявшиеся в других областях медицины), например, тоцилизумаб [52], гидроксихлорохин [53], пентоксифиллин [34], рекомбинантный интерферон бета-1b, лопинавир/ритонавир, рибавирин [54], камостат мезилат, ремдесивир, фавипиравир, барицитиниб, плазма выздоравливающих от COVID-19, человеческие моноклональные антитела [55].
Применение средств, обладающих воздействием на различные семейства фосфодиэстеразы, представляется потенциально полезным при обсуждаемой инфекционной патологии. Научно-исследовательская база по изучению свойств пентоксифиллина, обладающего ингибирующими свойствами в отношении ФДЭ-4, позволяет рассматривать данный препарат в качестве адъювантного лекарства при лечении пациентов с COVID-19. Ранее доказанные в клинических исследованиях и в условиях реальной клинической практике противовоспалительные, антиоксидантные, иммуномодулирующие, противовирусные, антитромботические и некоторые другие эффекты пентоксифиллина у пациентов с различными соматическими, эндокринными, аутоиммунными, инфекционными заболеваниями [56] позволяют в определённой степени интерполировать их на патологические процессы, актуальные при SARS-CoV-2 инфекции. Содержание в 1 таблетке пролонгированного высвобождения действующего вещества препарата Пентоксифиллин-СЗ, соответствующее 400 мг, оптимизирует его применение в суточных дозах, преимущественно используемых в мировой практике (800-120 мг). Вместе с тем, ожидаются результаты прямых исследований клинической эффективности пентоксифиллина у пациентов с COVID-19.
Применение пероральных селективных ингибиторов ФДЭ-5 в противовоспалительных, вазопротективных, антиремоделирующих и других клинических целях вполне научно обосновано и подкреплено солидной составляющей по изучению влияния этих препаратов на различные патогенетические механизмы, с которыми ассоциируются фатальные события при COVID-19. Таким образом, ингибиторы ФДЭ-5 – достойные кандидаты для обсуждения их места в схемах терапии SARS-CoV-2 инфекции и её осложнений. Силденафил-кардио обладает целым рядом свойств, позволяющих в варианте off-label использовать его как противовоспалительное, антиоксидантное, иммунокорригирующее, антиапоптическое средство при лечении пациентов с COVID-19. Гибкость подхода к назначению силденафила и других препаратов этого класса обусловлена доступностью различных доз, форм (таблетированных, диспергируемых), режимов (ежедневно или по требованию).
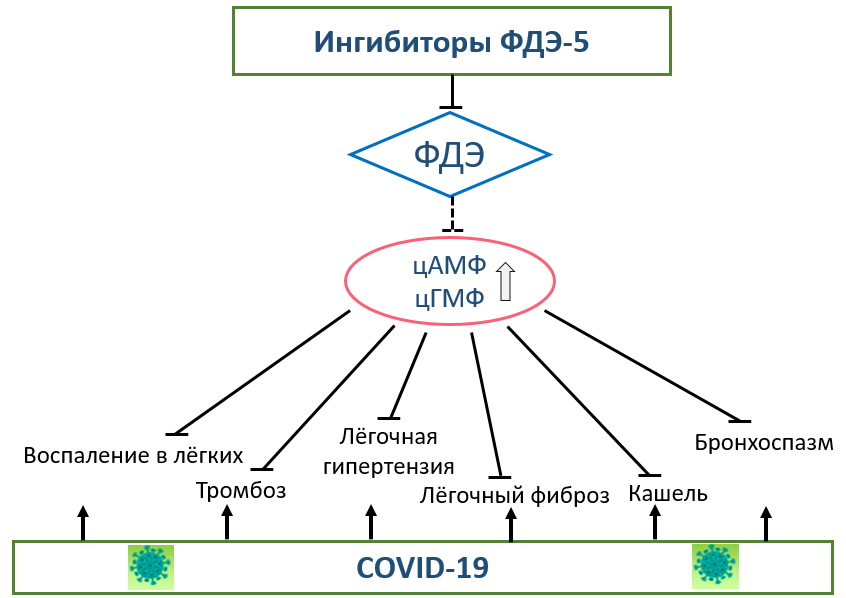
Рисунок 1. Патологические процессы, актуальные при SARS-CoV-2 инфекции и представляющие мишень для ингибиторов фосфодиэстеразы-5.
Список литературы
1. Furuyama W, Marzi A. Ebola Virus: Pathogenesis and Countermeasure Development. Annu Rev Virol 2019;6(1):435-458.
2. Musso D, Ko AI, Baud D. Zika Virus Infection - After the Pandemic. N Engl J Med 2019;81(15):1444-1457. DOI: 10.1056/NEJMra1808246.
3. Ahn D, Shin H, Kim M, Lee S, Kim H, Myoung J, Kim B, Kim S. Current status of epidemiology, diagnosis, therapeutics, and vaccines for novel coronavirus disease 2019 (COVID-19). J Microbiol Biotechnol 2020; 30:313-324.
4. Mostafa T. Could oral PDE-5 inhibitors have a potential adjuvant role in combating COVID-19 infection? Sexual Medicine Review (2020), DOI: org/10.1016/j.sxmr.2020.08.006.
5. Li Y, Zhou W, Yang L, You R. Physiological and pathological regulation of ACE2, the SARS-CoV-2 receptor. Pharmacol Res 2020; 157:104833.
6. Yan C, Kim D, Aizawa T, Berk BC. Functional interplay between angiotensin II and nitric oxide cyclic GMP as a key mediator. Arterioscler Thromb Vasc Biol 2003; 23:26-36.
7. Busse LW, Chow JH, McCurdy MT, Khanna AK. COVID-19 and the RAAS-a potential role for angiotensin II? Crit Care 2020; 24: 136.
8. Isidori AM, Giannetta E, Pofi R et al. Targeting the NO-cGMP-PDE5 pathway in COVID-19 infection. Andrology 2020 (in press). DOI: 10.1111/andr.12837.
9. Koka V, Huang XR, Chung AC et al. Angiotensin II up-regulates angiotensin I-converting enzyme (ACE), but down-regulates ACE2 via the AT1-ERK/p38 MAP kinase pathway. Am J Pathol 2008; 172:1174–1183.
10. Fernandes T, Hashimoto NY, Magalhaes FC et al. Aerobic exercise training-induced left ventricular hypertrophy involves regulatory MicroRNAs, decreased angiotensin-converting enzyme-angiotensin ii, and synergistic regulation of angiotensin-converting enzyme 2-angiotensin (1-7). Hypertension 2011; 58:182–189.
11. Ishiyama Y, Gallagher PE, Averill DB et al. Upregulation of angiotensin-converting enzyme 2 after myocardial infarction by blockade of angiotensin II receptors. Hypertension 2004; 43:970–976.
12. Qiao Z, Zhang H, Ji HF, Chen Q. Computational view toward the inhibition of SARS-CoV-2 spike glycoprotein and the 3CL protease. Computation (Basel) 2020; 8(2):53.
13. Corbin JD, Beasley A, Blount MA, Francis SH. High lung PDE5: A strong basis for treating pulmonary hypertension with PDE5 inhibitors Biochem Biophys Res Commun 2005; 334:930-938.
14. Galie N, Corris PA, Frost A et al. Updated treatment algorithm of pulmonary arterial hypertension. J Am Coll Cardiol 2013; 62:D60-D72.
15. Galiè N, Humbert M, Vachiery J et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Resp J 2015 46: 903-975. DOI: 10.1183/13993003.01032-2015.
16. Beltrán-Gámez ME, Sandoval-Zárate J, Pulido T. Phosphodiesterase-5 inhibitors for the treatment of pulmonary arterial hypertension. Arch Cardiol Mex 2015; 85:215-224.
17. Karasu-Minareci E, Ozbudak IH, Ozbilim G, Sadan G. Acute effects of vardenafil on pulmonary artery responsiveness in pulmonary hypertension. Sci World J 2012; 2012:718279.
18. Kiss T, Kovacs K, Komocsi A, et al. Novel mechanisms of sildenafil in pulmonary hypertension involving cytokines/chemokines, MAP kinases and Akt. PLoS One 2014; 9:e104890.
19. Barnes H, Brown Z, Burns A, Williams T. Phosphodiesterase 5 inhibitors for pulmonary hypertension. Cochrane Database Syst Rev 2019; 1(1):CD012621.
20. Kosutova P, Mikolka P, Balentova S et al. Effects of phosphodiesterase 5 inhibitor sildenafil on the respiratory parameters, inflammation and apoptosis in a saline lavage-induced model of acute lung injury. J Physiol Pharmacol 2018; 69(5).
21. Blanco I, Gimeno E, Munoz PA et al. Hemodynamic and gas exchange effects of sildenafil in patients with chronic obstructive pulmonary disease and pulmonary hypertension. Am J Respir Crit Care Med 2010; 181:270-278.
22. Vitulo P, Stanziola A, Confalonieri M et al. Sildenafil in severe pulmonary hypertension associated with chronic obstructive pulmonary disease: A randomized controlled multicenter clinical trial. J Heart Lung Transplant 2017; 36:166-174.
23. Faoro V, Lamotte M, Deboeck G et al. Effects of sildenafil on exercise capacity in hypoxic normal subjects. High Alt Med Biol 2007; 8:155-163.
24. Gibbs JS. Biventricular function at high altitude: implications for regulation of stroke volume in chronic hypoxia. Adv Exp Med Biol 2007; 618:13-24.
25. Watanabe N, Taniguchi H, Kondoh Y et al. Clinical efficacy of sildenafil in interstitial pneumonia with pulmonary hypertension. Nihon Kokyuki Gakkai Zasshi 2011; 49:151-155.
26. Gammella E, Leuenberger C, Gassmann M, Ostergaard L. Evidence of synergistic/additive effects of sildenafil and erythropoietin in enhancing survival and migration of hypoxic endothelial cells. Am J Physiol Lung Cell Mol Physiol 2013; 304:L230-L239.
27. Czövek D, Peták F, Donati Y et al. Prevention of hyperoxiainduced bronchial hyperreactivity by sildenafil and vasoactive intestinal peptide: impact of preserved lung function and structure. Respir Res 2014; 15:81.
28. Zhang HX, Liu SJ, Tang XL et al. H2S attenuates LPSinduced acute lung injury by reducing oxidative/nitrative stress and inflammation. Cell Physiol Biochem 2016; 40:1603-1612.
29. Yao Z, Wang C. A novel mechanism of sildenafil improving the excessive proliferation and H2S production in pulmonary arterial smooth muscle cells. J Cardiovasc Pharmacol 2019; 74:355-363.
30. de Visser YP, Walther FJ, Laghmani E et al. Sildenafil attenuates pulmonary inflammation and fibrin deposition, mortality and right ventricular hypertrophy in neonatal hyperoxic lung injury. Respir Res 2009; 10:30.
31. Giorgi M, Cardarelli S, Ragusa F et al. Phosphodiesterase Inhibitors: Could They Be Beneficial for the Treatment of COVID-19? Int J Mol Sci 2020, 21, 5338; DOI:10.3390/ijms21155338.
32. Rapôso C, Luna RL, Nunes AK et al. Role of iNOS-NO-cGMP signaling in modulation of inflammatory and myelination processes. Brain Res Bull 2014; 104: 60–73.
33. Dalamaga M, Karampela I, Mantzorosc CS. Commentary: Phosphodiesterase 4 inhibitors as potential adjunct treatment targeting the cytokine storm in COVID-19. Metabolism 2020; 109:154282.
34. Seirafianpour F, Mozafarpoor S, Fattahi N et al. Treatment of COVID-19 with pentoxifylline: Could it be a potential adjuvant therapy? Dermatol Ther 2020 (in press). DOI: 10.1111/dth.13733.
35. Cadirci E, Halici Z, Odabasoglu F et al. Sildenafil treatment attenuates lung and kidney injury due to overproduction of oxidant activity in a rat model of sepsis: a biochemical and histopathological study. Clin Exp Immunol 2011; 166:374-384.
36. Deng M, Loughran PA, Zhang L et al. Shedding of the tumor necrosis factor (TNF) receptor from the surface of hepatocytes during sepsis limits inflammation through cGMP signaling. Sci Signal 2015; 8(361):ra11.
37. Vlachopoulos C, Ioakeimidis N, Rokkas K et al. Acute effect of sildenafil on inflammatory markers/mediators in patients with vasculogenic erectile dysfunction. Int J Cardiol 2015; 182:98-101.
38. Wolter S, Dittmar F, Seifert R. cCMP and cUMP in apoptosis: Concepts and methods. Handb Exp Pharmacol 2017; 238:25-47.
39. Choi DE, Jeong JY, Lim BJ et al. Pretreatment of sildenafil attenuates ischemia-reperfusion renal injury in rats. Am J Physiol Renal Physiol. 2009; 297:F362-F370.
40. Puzzo D, Loreto C, Giunta S et al. Effect of phosphodiesterase-5 inhibition on apoptosis and beta amyloid load in aged mice. Neurobiol Aging 2014; 35:520-531.
41. Duarte-Silva E, Peixoto CA. Molecular mechanisms of phosphodiesterase-5 inhibitors on neuronal apoptosis. DNA Cell Biol 2018; 37:861-865.
42. Gong W, Duan Q, Cai Z et al. Chronic inhibition of cGMP-specific phosphodiesterase 5 suppresses endoplasmic reticulum stress in heart failure. Br J Pharmacol 2013; 170: 1396–1409.
43. Liu X, Peyton KJ, Wang X, Durante W. Sildenafil stimulates the expression of gaseous monoxidegenerating enzymes in vascular smooth muscle cells via distinct signaling pathways. Biochem Pharmacol 2012; 84: 1045–1054.
44. Abdel Aziz MT, Mostafa T, Atta H et al. Putative role of carbon monoxide signaling pathway in penile erectile function. J Sex Med 2009; 6:49-60.
45. Li FJ, Duggal RN, Oliva OM et al. Heme oxygenase-1 protects corexit 9500A-induced respiratory epithelial injury across species. PLoS One 2015; 10:e0122275.
46. Espinoza JA, León MA, Céspedes PF et al. Heme oxygenase-1 modulates human respiratory syncytial virus replication and lung pathogenesis during infection. J Immunol 2017; 199:212–223.
47. Perk H, Armagan A, Naziroğlu M et al. Sildenafil citrate as a phosphodiesterase inhibitor has an antioxidant effect in the blood of men. J Clin Pharm Ther 2008; 33:635-640.
48. Taibi G, Carruba G, Miceli V et al. Sildenafil protects epithelial cell through the inhibition of xanthine oxidase and the impairment of ROS production. Free Radic Res 2010; 44:232-239.
49. Yang HM, Jin S, Jang H et al. Sildenafil reduces neointimal hyperplasia after angioplasty and inhibits platelet aggregation via activation of cGMP-dependent protein kinase. Sci Rep 2019; 9:7769.
50. Gudmundsdóttir IJ, McRobbie SJ, Robinson SD et al. Sildenafil potentiates nitric oxide mediated inhibition of human platelet aggregation. Biochem Biophys Res Commun 2005; 337: 382-385.
51. Барсуков А.В. Место пентоксифиллина в современной кардиоваскулярной медицине. Клиническая патофизиология 2018; 24(1):61-71.
52. Luo P, Liu Y, Qiu L et al. Tocilizumab treatment in COVID-19: A single center experience. J Med Virol 2020; 92:814-818.
53. Patrì A, Fabbrocini G. Hydroxychloroquine and ivermectin: A synergistic combination for COVID-19 chemoprophylaxis and treatment? J Am Acad Dermatol 2020; 82:e221.
54. Hung IF, Lung KC, Tso EY et al. Triple combination of interferon beta-1b, lopinavir-ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomised, phase 2 trial. Lancet 2020; 395:1695-1704.
55. Santos J, Brierley S, Gandhi MJ et al. Repurposing therapeutics for potential treatment of SARS-CoV-2: A review. Viruses 2020; 12:E705.
56. Барсуков А.В. Кардиопротекторное значение ингибиторов фосфодиэстеразы-5: от патофизиологии к реальной клинической практике. Клиническая патофизиология 2018; 24(3):3-13.